동아ST, 파모티틴 바이알 아닌 주사액제로 편의성 높여
JDQ443, 폐암 외에도 다양한 진행성 고형암 타깃 임상 중

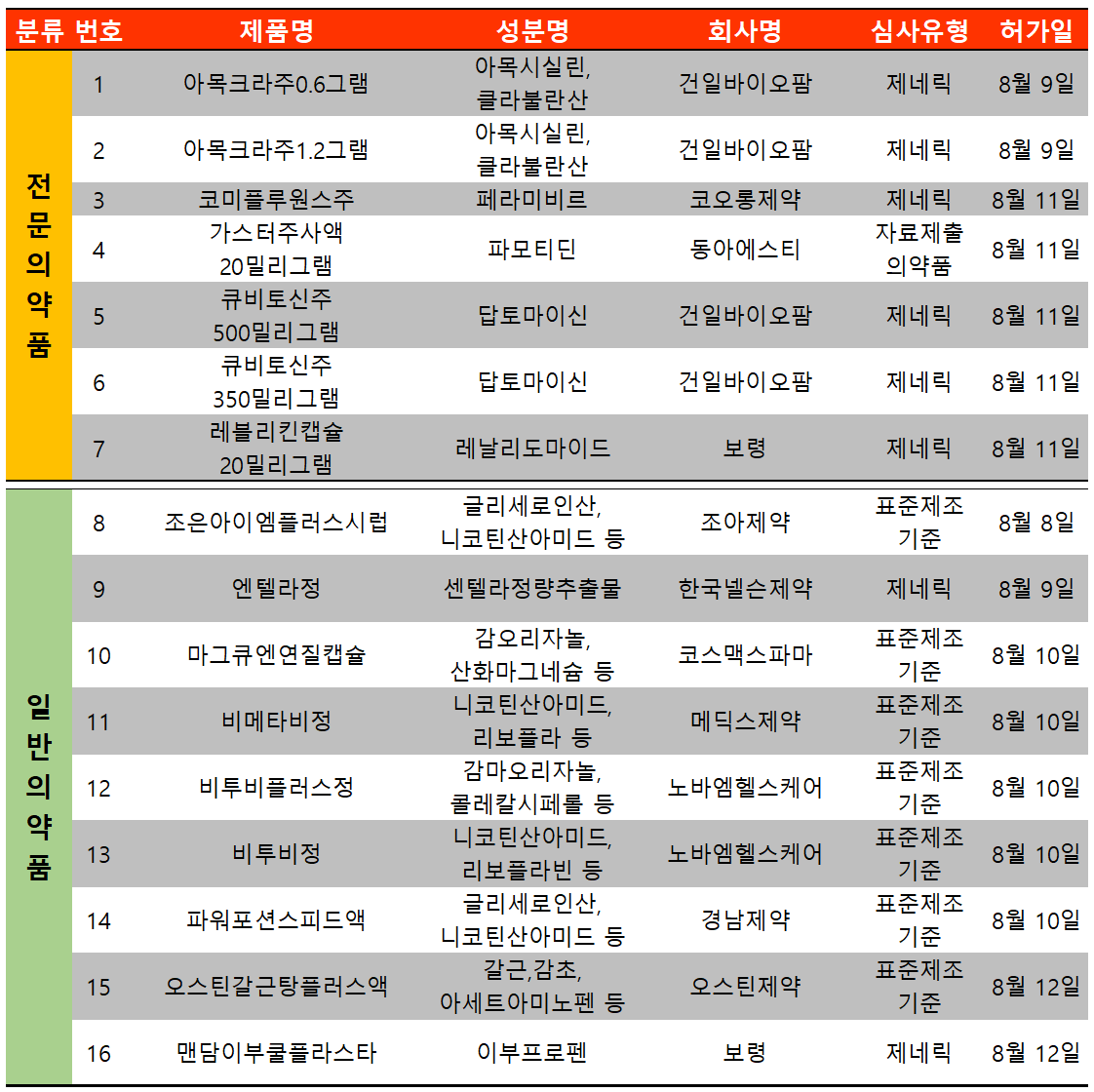
지난 주(8월 8일~8월 14일)에는 총 16개 품목이 식품의약품안전처로부터 허가받았다. 이 중 전문의약품은 7건, 일반의약품은 9건이었다.
파모티딘 주사제 시장을 리드하고 있던 동아ST가 바이알이 아닌 주자액제로 '가스터주사액 20mg'을 식약처에 허가받았다.
동아ST는 가스터디정20mg, 동아가스터정20mg, 동아가스터주20mg 등 3품목을 보유하고 있었다. 이중 동아가스터주는 생리식염주사액 또는 포도당 주사액에 녹여 사용해 편의성이 상대적으로 낮았다.
이번 허가받은 가스터주사액은 같은 상부소화관출혈 적응증으로 희석만 하면 사용할 수 있어 편의성을 높였다. 또한 경구제 투여가 어려운 환자군에서도 앞으로 보다 쉽게 파모티딘 주사제 사용이 가능해 진 것이다.
현재 파모티딘 주사제 시장 경쟁 제품으로는 명인제약 '모틴주'가 있으나 파모티딘 주사제 시장 매출액 100억 원대 규모 중 명인제약이 차지하는 비율은 1/10 가량으로 대부분의 매출을 동아ST가 올리고 있다.
한편 지난 7월 '파모티딘' 경구 성분 제제에 대한 국내 '아나필락시스' 사례가 보고됨에 따라 식약처는 허가변경 등 후속 안전조치를 예고했다.
그에 따라 경구 제제를 사용할 수 없는 환자군이 발생할 것으로 예상돼 향후 파모티딘 주사세 시장은 더욱 성장할 전망이다.
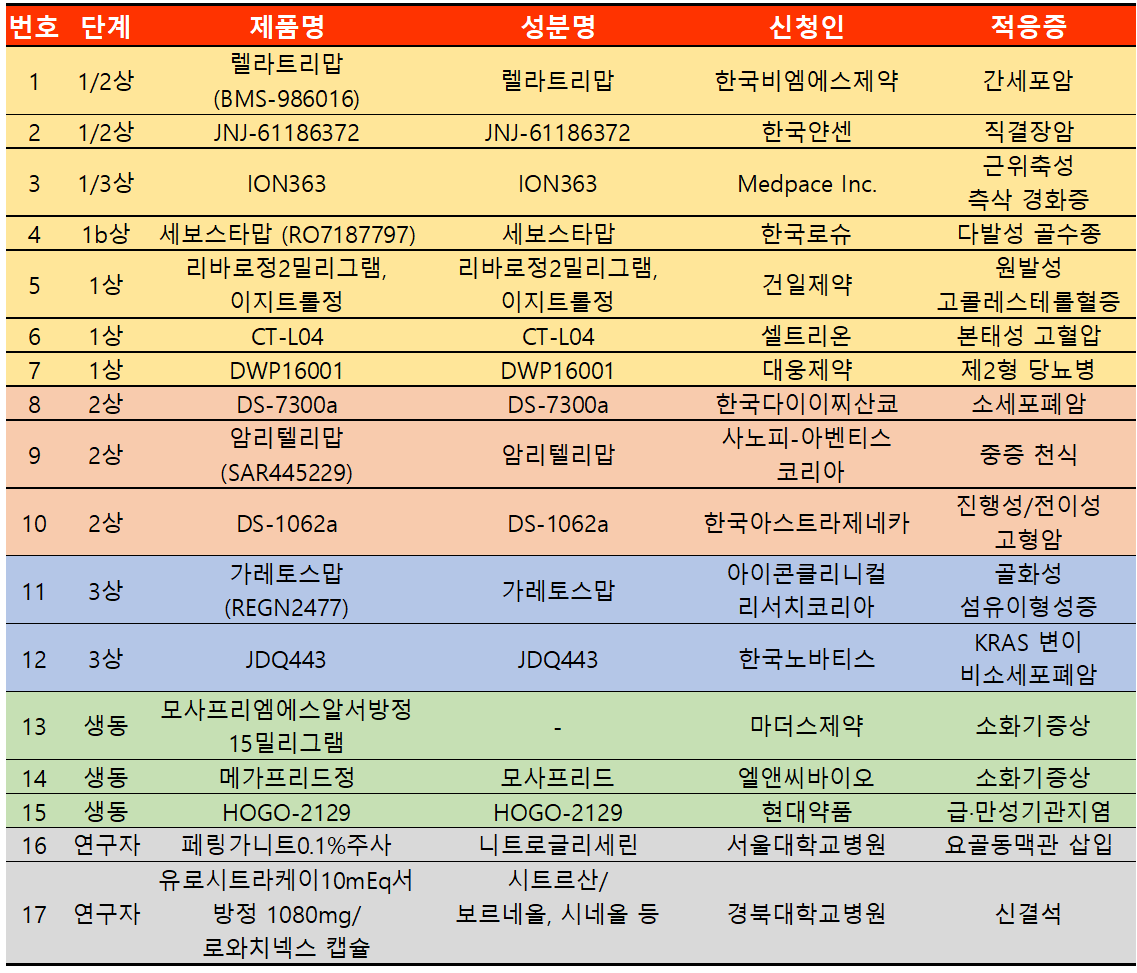
지난주 임상시험계획은 총 17건이 승인 완료됐다. 세부적으로 △임상1상 7건 △2상 3건 △3상 2건 △생동 3건 △연구자 임상 2건 등이다.
노바티스가 2021년 성과 발표를 통해 발표한 파이프라인 중 KRAS G12C 억제제인 'JDQ443'가 식약처 임상시험 3상 승인을 받았다.
'JDQ443'는 노바티스가 자체 개발하고 있는 KRAS G12C 억제제 후보물질로 현재 광범위한 KRAS G12C 변이 비소세포폐암 등 다양한 진행성 고형암 환자에서 1/2상 글로벌 임상시험을 진행 중이다.
JDQ443의 임상시험은 KontRASt 연구가 바탕이며 발표된 결과에 따르면 비소세포폐암에서 200mg의 단일 요법 권장 용량(BID) 부분에서 7명 중 4명에서 객관적 반응률(ORR)을 확인했고 하위 그룹 20명 중 9명에서도 ORR을 확인했다.
식약처가 승인한 임상 3상은 KontRASt-02 연구로 이전에 치료 받은 국소 진행성 또는 전이성 KRAS G12C 돌연변이 비소세포폐암이 있는 시험대상자에서 JDQ443 대 도세탁셀의 유효성 및 안전성을 평가하기 위해 승인됐다.
전체 대상사 수 360명 중 국내 대상자는 16명이 계획됐으며 서울아산병원이 실기기관이다.
노바티스 항암제 및 혈액학 개발부 책임자인 제프 레고스(Jeff Legos) 수석 부사장은 JDQ443에 대해 "우리 업계는 KRAS 돌연변이 암 표적 치료의 변혁적인 시대에 접어들고 있다. 그러나 미충족 수요로 약물 내성이 남아 있다"며 "JDQ443이 그러한 도전을 극복할 잠재력이 있다고 믿는다. 이번 데이터는 우리가 KRAS 표적 요법의 효능을 향상시키기 위해 올바른 길을 가고 있다는 신호"라고 설명했다.

